◆ 摘 要
為了獲得更易控制與足夠的拉力,靜磁鐵在矯正醫學上的應用越來越多,但有關靜磁鐵所產生的磁場對生物組織影響之研究,卻仍無定論。在磁場對纖維母細胞的影響上,不同的實驗室也有不同的研究結果。為了更進一步瞭解矯正用磁鐵所可能產生的磁場強度對纖維母細胞的影響,本研究於細胞培養器中培養受磁場作用與未作用的纖維母細胞,並比較其細胞活性。實驗結果顯示,未受磁場作用的纖維母細胞之細胞活性,會比曝露於磁場中的細胞來得大。且其差異會隨著實驗天數的增加而增加。本研究結果顯示,矯正磁鐵對口腔纖維組織的影響有更深入探討的必要。
◆ 緒 論
磁鐵是口腔醫學常使用的一種裝置,其最早的應用多集中於全口假牙的固定及作為牙齒贗復的連接裝置(Thompson, 1964; Winkler, 1967; Javid, 1971)。然而由於早期的磁鐵材料如鋁-鎳-鈷合金(AlNiCo)或鈷-鉑合金(PtCo)的磁力強度仍然不足,因此在應用上仍有相當的限制。近幾年來,由於稀土金屬(rear earth metal)磁鐵製作技術的進步,尤其是銣鐵硼磁鐵(NdFeB)的發明,使得磁鐵得以在小型化之後仍能擁有足夠的磁力,這不僅使得磁鐵可以提供贗復義齒所需的結合力(Melissa et al., 2001),更可作為臨床矯正所需的力量來源(Darendeliler et al., 1997)。但隨著磁鐵的應用日廣及高磁化製造技術的進步,磁場對組織的生物效應也開始受到牙醫師的關切。
磁鐵的形式依其產生的原因可以分為電磁鐵(electromagnet)與永久磁鐵(permanent magnet),其中電磁鐵依其供電方式的不同又可以產生不同的磁場形式,分別為交流磁場(alternative current electromagnetic field, ACMF)、直流脈衝式磁場(pulsed electromagnetic field, PEMF)及直流靜磁場(static electromagnetic field, SMF)三種;而永久磁鐵所產生的磁場並不會因為時間的改變而改變,因此亦為靜磁場的一種。最早提出磁場對生物有負面影響的是1979年Wertheimer 及Leeper的一篇公共衛生學報導,他們的研究發現,交流電所產生的交流磁場會導致小兒白血病及腦部的腫瘤,此篇論文雖然在研究方法上受到很大的質疑,但卻也開啟了長達二十年的論戰。有關交流磁場是否會導致細胞病變,正面及負面的研究結果都很多,但近幾年的研究結果傾向於認為,交流磁場對細胞變性的影響是間接的作用,並不會直接作用在DNA上,但在細胞發生變性時,交流磁場會抑制變性細胞的自我死亡機制(programmed cell death),而導致變性細胞持續成長與增生,同時這樣的作用是具有細胞選擇性的(Liburdy et al., 1993; Harland & Liburdy, 1997; Simko et al., 1998; Fanelli et al., 1999; Leman et al., 2001; Blackman et al., 2001)。
不同於交流磁場對生物組織的負面作用,直流脈衝式磁場很早就被用來作為促進骨頭增生,並成為治療骨折後長久不癒合的工具(Bassett, 1989),其作用機制是利用通電的線圈在骨頭上所產生的感應電流,來達到電刺激骨質增生的目的(Friedenberg et al., 1971)。由於脈衝式電磁場刺激骨癒合的成功率可以達到80%以上,且幾乎不受骨折位置、不癒合期及手術次數的影響(Basett et al., 1981; Sharrard et al., 1982; Garland et al., 1991),因此早在1979年美國食品藥物管理局(FDA)即已核准這項治療技術,迄今已實際普遍地應用在臨床治療上,並獲致很好的療效(Gossing et al., 1992; Trock, 2000 )。
由以上可知,磁場對生物組織的影響會因磁場形式與作用細胞的不同而有不同的結果。目前臨床矯正常用的磁鐵都是永久磁鐵,其所產生的靜磁場與生物組織的交互作用主要可能有三個(Trock, 2000):第一,是電磁感應效應,即其會對體內電解質溶液中的離子產生一個作用力;第二,是磁-力效應(magnetomechanical effect),即均勻的靜磁場可能與體內某些特定分子發生交互作用,例如Atef 等人(1995)的報告即指出,靜磁場會改變血紅蛋白的構形,並進一步影響其帶氧的能力;第三,是帶電粒子的共振作用,即影響原子核和電子的自旋方向,但此作用對人體的影響,仍沒有明確的報告。
第一個矯正用的magnetic bracket是由Kawata等人(1977)設計,一年後更採用稀土金屬作為磁鐵材料(Kawata et al., 1978; Kawata & Matsuga, 1979),以提供更大的磁力。其後的臨床報告均顯示,磁鐵的使用在特定的情形中,確實可以提供更好的力量控制與便利性(Blechman, 1985; Gianelly et al., 1989; Darendeliler & Joho, 1992),並加速牙齒的移動(Darendeliler et al., 1995)。然而,雖然離體實驗結果認為稀土金屬材料本身對人體組織的毒性作用可以忽略(Tsutsui et al., 1979; Bondemark et al., 1994a,1994b),且臨床使用的磁鐵均已做過鍍層處理,以減少磁鐵材料釋出物對纖維母細胞(fibroblast)可能的生長抑制作用(Evans & McDonald, 1995),但對於磁鐵所產生磁場之生物作用,一直到近幾年才漸被重視並有較深入的探討。
如表一所示,靜磁鐵對pulp、buccal gingival、buccal mucosa、osteoblast等口腔細胞或組織並沒有明顯的作用(McDonald, 1993; Bondemark et al. 1995a; Bondemark et al., 1998),而對於纖維母細胞影響的研究,則因不同的實驗室與實驗方法而有不同的結果。
Linder-Aronson 與 Lindskog (1995)曾將人類牙周韌帶中的纖維母細胞進行體外培養,發現受靜磁場刺激之細胞數目,明顯地低於未曝露於磁場下的控制組。這樣的結果與稍早McDonald (1993)的發現完全相反,McDonald的實驗是在體外培養老鼠尾部取出的纖維母細胞,並發現曝露於磁場的細胞會有比較明顯的細胞增殖現象,他們因此推論靜磁場的曝露會導致口腔內如牙周韌帶或牙齦組織的增生。此外,Wiskirchen 等人(1999, 2000)亦曾將人類肺部的纖維母細胞長期地曝露於2000-15000高斯的強磁場中,以研究核磁共振儀對纖維母細胞的影響,卻發現纖維母細胞的生長在強磁場的長時間作用下,並未受到任何明顯的影響。沒有一個實驗室的結果曾被另外的獨立研究室證實過(Darendeliler et al., 1997)。由於各家實驗的結果相差很大,因此本研究室特針對磁場對纖維母細胞的生長反應進行驗證。
|
|
◆ 實驗結果與討論
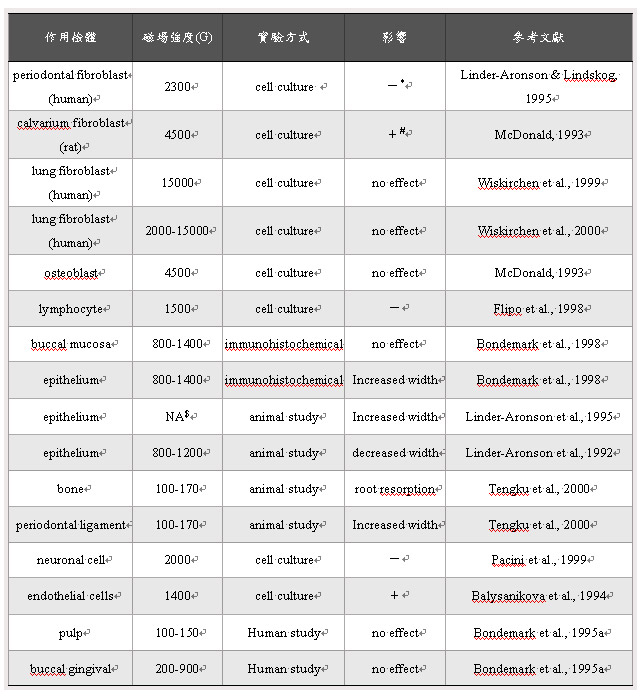
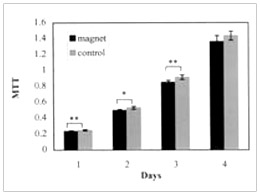
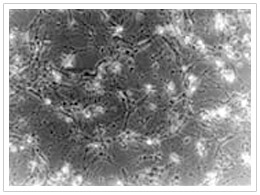
(圖二)為纖維母細胞受磁場曝露與未受磁場曝露時,其MTT測試之結果,在四天的測試中,未受曝露的細胞均有較高的細胞活性,其中前三天有顯著的差異(p<0.05)或極顯著的差異(p<0.001)。此外,磁場曝露與未曝露組之MTT平均值差異於第1, 2, 3, 4天分別為0.015, 0.031, 0.063, 及0.074,亦有越來越大之趨勢。而在以4000高斯磁場強度作用於纖維母細胞之後,受曝露的細胞於第三天發生明顯的死亡現象,而未受磁場的細胞則狀況良好(如圖三)。
早期曾有許多的研究討論磁鐵對口腔組織的影響,但當時的研究大多著重於磁鐵材料本身或其釋出物的生物毒性,因此當時的結論為經過表面鍍層處理的磁鐵並沒有生物毒性,因此認為磁鐵裝置是無害的(Tsutsui et al., 1979; Darendeliler et al., 1997)。至於磁鐵所產生的磁場之生物效應則較少被討論,再加上近年來磁鐵材料與製造技術的進步,所能提供的磁場強度遠非早期的磁鐵裝置所能相比。
本研究室的實驗結果則顯示,受磁場曝露的纖維母細胞會有明顯的細胞活性下降的趨勢,此結果與Linder-Aronson 與 Lindskog (1995)對人類牙周韌帶中的纖維母細胞所進行的體外培養實驗之結果一致。至於這樣的結果與McDonald (1993)及Wiskirchen等人(1999, 2000)的實驗結果不同的原因,或許是因為他們的實驗所培養的纖維母細胞並不是來自口腔組織,且其所曝露的磁場強度遠高於臨床矯正所使的1700-2000 高斯之磁場強度 (Bondemark et al., 1994c; Bondemark et al., 1995b)。最近的研究也發現,不同的細胞種類對靜磁場刺激的反應與程度會有很大的差別(Fanelli et al., 1999)。這樣的變異性與特異性似乎也存在不同組織中的纖維母細胞。
由於身體組織對靜磁場的影響幾乎沒有遮蔽作用(Rapachoil & Greenebaum , 1999),因此臨床矯正時使用的磁鐵所產生的磁場,是可能達到纖維母細胞的位置,而首當其衝的可能就是牙周韌帶與牙齦組織。但因為體外的細胞培養實驗與真實組織中的情形仍有不同,因此,是否靜磁鐵同樣會使得口腔組織中的纖維母細胞之生長及活性受到抑制,仍有待更進一步的實驗加以探討,但本研究結果卻指出了一個重點,即在未有大規模的體內與離體實驗結果證實磁場的作用之前,不斷地增加磁場強度以獲取更大的矯正拉力,是值得商榷的。此外,由於體外細胞培養實驗並不適合進行長時間(long-term)的研究與觀察,因此口腔組織與細胞對磁鐵長時間作用的影響也有待更進一步的研究及探討。
◆ 參考文獻
Atef MM, Elhaset MSA, Elkareem A, Aida S, Fadel MS. (1995)Effects of a static magnetic field on haemoglobin structure and function. Int J Biol Macromol 17:105-111.
Balysankiova IV, Krotov KA, Danilov SM. (1994) Effect of a static magnetic field on the growth rate and in vitro angiogenesis of endothelial cells. Bullet Exp Biol Med 117: 106-108.
Bassett CAL, Mitchell SN, Gaston SR. (1981) Treatment of ununited tibial diaphyseal fractures with pulsing electromagnetic fields. J Bone Joint Surg 63(A): 511-523.
Bassett CAL. (1989) Fundamental and practical aspects of therapeutic uses of PEMF. Crit Rev Biomed Eng 17: 451-529.
Blackman CF, Benane SG, House DE. (2001) The influence of 1.2T, 60 Hz magnetic fields on melatonin- and tamoxifen-induced inhibition of MCF-7 cell growth. Bioelectromagnetics 22: 122-128.
Blechman AM. (1985) Magnetic force system in orthodontics, clinical results of a pilot study. Am J Orthod 87: 201-210.
Bondemark L, Kurol J, Wennberg A. (1994a) Biocompatibility of new, clinically, and recycled orthodontic samarium-cobalt magnets. Am J Orthod Dentfac Orthop 105: 568-574.
Bondemark L, Kurol J, Wennberg A. (1994b) Orthodontic rare earth magnets-in vitro assessment of cytotoxicity. Brit J Orthod 21: 335-341.
Bondemark L, Kurol J, Wisten A. (1994c) Static magnets-fields of orthodontic magnets. Eur Orthod Soc 42: 83.
Bondemark L, Kurol J, Larsson A. (1995a) Human dental pulp and gingival tissue after static magnetic field expose. Eur J Orthod 17: 85-91.
Bondemark L, Kurol J, Wisten A. (1995b) Extent and flux density of static magnetic fields generated by orthodontic samarium-cobalt magnets. Am J Orthod Dentfac Orthop 107: 488-496.
Bondemark L, Kurol J, Larsson A. (1998) Long-term effects of orthodontic magnets on human buccal mucosa- a clinical, histological and immunohistochemical study. Eur J Orthod 20: 211-218.
Darendeliler MA, JohoJP. (1992) Class II bimaxillary protrusion treated with magnetic force. Case report. J Clin Orthod 26: 361-368.
Darendeliler MA, Sinclair PM, Kusy RP. (1995) The effects of samarium-cobalt magnets and pulsed electromagnetic fields on tooth movement. Am J Orthod Dentfac Orthop 107: 578-588.
Darendeliler MA, Darendeliler A, Mandurino M. (1997) Clinical application of magnets in orthodontics and biological implications: a review. Eur J Orthod 19:431-442.
David HT. (2000) Electromagnetic fields and magnets. Rheum Dise Clin Nor Am 26: 51-62.
Evans RD, McDonald F. (1995) Effects of magnet corrosion products (neodymium iron boron) on oral fibroblast proloferation. J Appl Biomater 6: 199-202.
Fanelli C, Coppola S, Barone R, Colussi C, Gualandi G, Volpe P, Ghibelli L. (1999) Magnetic fields increase cell survival by inhibiting apoptosis via modulation of ca2+ influx. FASEB J 13: 95-102.
Flipo D, Fournier M., Benquet C, Roux P, Boulaire CL, Pinnsky C, LaBella FS, Krzystyniak K. (1998) Increased apoptosis, changes in intracellular ca2+, and functional alterations in lymphocytes and macrophages after in vitro exposure to static magnetic field. J Toxic Environ Health, Part A, 54: 63-76.
Friedenberg ZB, Harlow MC, Brighton CT. (1971) Healing of non-union of the medical malleolus by means of direct current: a case report. J Trauma 11:883.
Garland DE, Moses B, Salyer W. (1991) Long-term follow-up of fracture nonunions treated with PEMFs. Contemp Orthop 22: 295-302.
Gianelly AA, Vaitas AS, Thomas WM. (1989) The use of magnets to move molars distally. Am J Orthod Dentofac Orthop 96: 161-167.
Harland JD, Liburdy RP. (1997) Enviromental magnetic fields inhibit the antiproliferative action of tamoxifen and melatonin in a human breast cancer cell line. Bioelectromagnetics 18: 555-562.
Javid N. (1971) The use of magnets in a maxillofacial prosthesis. J Prosth Dent 25: 334-341.
Kawata T et al. (1977)A new orthodontic appliance by means of magnetic bracket. J Dent Res 56: D162.
Kawata T, Matsuga M, Kitano N, Kishigami H. (1978) Futher study of a new orthodontic treatment with a magnetic appliance. J Dent Res 57: 175.
Kawata T, Matsuga M. (1979) A study of new orthodontic treatment by means of magnet. J Dent Res 58: 1292.
Leman ES, Sisken BF, Zimmer S, Anderson KW. (2001) Studies of the interactions between melatonin and 2 Hz, 0.3 mT PEMF on the proliferation and invasion of human breast cancer cells. Bioelectromagnetics 22: 178-184.
Liburdy Rp, Sloma TR, Sokolic R, Yaswen P. (1993) ELF magnetic fields, breast cancer, and melatonin: 60 Hz fields block melatonin's oncostatic action on ER+ breast cancer cell proliferation. J Pineal Res. 14: 89-97.
Linder-Aronson A, Lindskog S, Rygh P. (1992) Orthodontic magnets: effects on gingival epithelium and alveolar bone in monkeys. Eur J Orthod 14:255-263.
Linder-Aronson A, Lindskog S. (1995) Effects of static magnetic fields on human periodontal fibroblasts in vitro. Swed Dent J 19: 131-137.
Linder-Aronson A, Rygh P, Lindskog S. (1995) Effects of orthodontic magnets on cutaneous epithelial thickness and tibial bone growth in rats. Acta Odontol Scand 53: 259-263.
McDonald F. (1993) Effect of static magnetic fields on osteoblasts and fibroblasts in vitro. Bioelectromagnetics 14: 187-196.
Melissa AR, Anthony DW, Ivor RH. (2001) Magnets in prosthetic dentistry. J Prosth Dent 86: 137-142.
Pacini S, Vannelli GB, Barni T, Ruggiero M, Sardi I, Pacini P, Gulisano M. (1999) Effects of 0.2 T static magnetic field on human neurons: remodeling and inhibition of signal transduction without genome instability. Neuro sci Lett 267: 185-188.
Rapachoil MH, Greenebaum B. (1999) Interaction of static and extremely low frequency electric and magnetic fields with living systems: health effects and research needs. Bioelectromagnetics 20: 133-160.
Sharrard WJ, Sutcliffe ML, Robson MJ, Maceachern AG.(1982) The treatment of fibrous non-union of fractures by pulsing electromagnetic stimulation. J Bone Joint Surg 64B: 189-193.
Simko M, Kriehuber R, Weiss DG, Luben RA. (1998) Effects of 50 Hz EMF exposure on micronucleus formation and apoptosis in transformed and nontransformed human cell lines. Bioelectromagnetics 19: 85-91.
Tengku BS, Joseph BK, Harbrow D, Taverne AAR, Symons AL. (2000) Effect of a static magnetic field on orthodontic tooth movement in the rat. Eur J Orthod 22: 475-487.
Thompson IM. (1964) Magnetism as an aid to a prosthetic problem. Brit J Surg 2: 44-46.
Wertheimer N, Leeper E. (1979) Electrical wiring configurations and childhood cancer. Am J Epidemiol 109: 273-284.
Winkler S. (1967) The effectiveness of embedded magnets on complete dentures during speech and mastication: a cineradiographic study. Dent Digest 73:118.
Wiskirchen J, Gronewaller EF, Kehlbach R, Heinzelmann F, Wittau M, Rodemann HP, Claussen CD, Duda SH. (1999) Long-term effects of repeatitive exposure to a static magnetic field (1.5 T) on proliferation of human fetal lung fibroblasts. Magnet Reson Med 41: 464-468.
Wiskirchen J, Gronewaller EF, Kehlbach R, Rodegerdts E, Wittau M, Rodemann HP, Claussen CD, Duda SH. (2000) Human fetal lung fibroblasts: in vitro study of repetitive magnetic field exposure at 0.2, 1.0, 1.5 T. Radiology 215: 858-862.
|